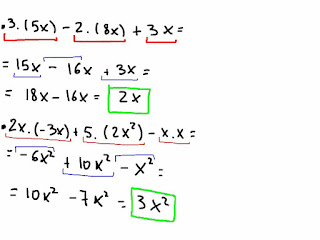Doniban
martes, 21 de abril de 2020
domingo, 19 de abril de 2020
2º ESPA: Grasas saturadas, insaturadas y colesterol
Ayer surgieron dudas sobre la dieta, las grasas (lípidos) y la influencia en el colesterol. Creo que este enlace podemos encontrar las respuestas...
Algunas conclusiones son:
- Las grasas son necesarias para el correcto funcionamiento del organismo: ayuda a mantener la temperatura, intervienen en la absorción de distintas vitaminas y contribuye a mantener la piel y pelo en buen estado.
- Nuestro cuerpo obtiene la energía de los hidratos de carbono (o carbohidratos) en primera instancia, y posteriormente recurre a las grasas.
- Las grasas están compuestas de ácidos grasos saturados (elevan el colesterol malo) e insaturados (bajan el colesterol).
- Alimentos ricos en ácidos grasos saturados: proceden de animales como la leche entera, mantequilla, queso, helado, crema, carne rica en grasas; otro alimento perjudicial es el aceite de palma, base de gran cantidad de productos eleborados.
- El consumo de ácidos grasos saturados está relacionado con la aparición de colesterol, aumento de la tensión y accidentes cardiovasculares (infarto de corazçon y/o cerebro).
Etiquetas:
2016-2017,
2º ESPA,
Biología,
fyq2,
Naturales-2
3 ejercicios de repaso para el examen polinomios (Matemáticas - ESPA 3)
Calcula:
Saca factor común:
Traduce al lenguaje algebraico
- 2x2 - 7x2 + 5x - 1 - (8x2 - 6x + 2) + 9x + 6 =
- 9x.(2x2 + 8x + 6) =
- (-x2 + 4x - 3).(2x2 + 8x + 6) =
Saca factor común:
- 2x2 + 8x + 6 ver solución
- x4 +2x3 - 4x2 + 8x
- 12x4 - 6x3 + 9x2 - 3x
Traduce al lenguaje algebraico
- La sexta parte de un número
- El área de un triángulo rectángulo si uno de los lados es el triple de largo que el otro
- El doble de un número menos dos
Etiquetas:
- Polinomios,
2016-2017,
3º ESPA,
CEPA Santoña,
Matemáticas
viernes, 17 de abril de 2020
Ejercicios resueltos de ecuaciones de primer grado
x + x = 6
2x = 6
x = 6/2
x = 3
3x = 2 + 4
3x = 6
x = 6/3
x = 2
2x - 3 = 7
2x = 7 + 3
2x = 10
x = 10/2
x = 5
2x + 3x = 10
5x = 10
x = 10/5
x = 2
5x = 2 + 3
5x = 5
x = 5/5
x = 1
3x + 2 = 14
3x = 14 - 2
3x = 12
x = 12/3
x = 4
4x + x = 5
5x = 5
x = 5/5
x = 1
2x = 5 + x
2x - x = 5
x = 5
7 = 4x - 1
-4x = -1-7
-4x = -8
x = (-4)/(-8)
x = 1/2
x + x = 6
2x = 6
x = 6/2
x = 3
3x = 2 + 4
3x = 6
x = 6/3
x = 2
2x - 3 = 7
2x = 7 + 3
2x = 10
x = 10/2
x = 5
2x + 3x = 10
5x = 10
x = 10/5
x = 2
5x = 2 + 3
5x = 5
x = 5/5
x = 1
3x + 2 = 14
3x = 14 - 2
3x = 12
x = 12/3
x = 4
4x + x = 5
5x = 5
x = 5/5
x = 1
2x = 5 + x
2x - x = 5
x = 5
7 = 4x - 1
-4x = -1-7
-4x = -8
x = (-4)/(-8)
x = 1/2
Tema 4 ciencias naturales CCNN: El sistema excretor
El sistema excretor
- Anatomía del aparato urinario masculino y femenino:
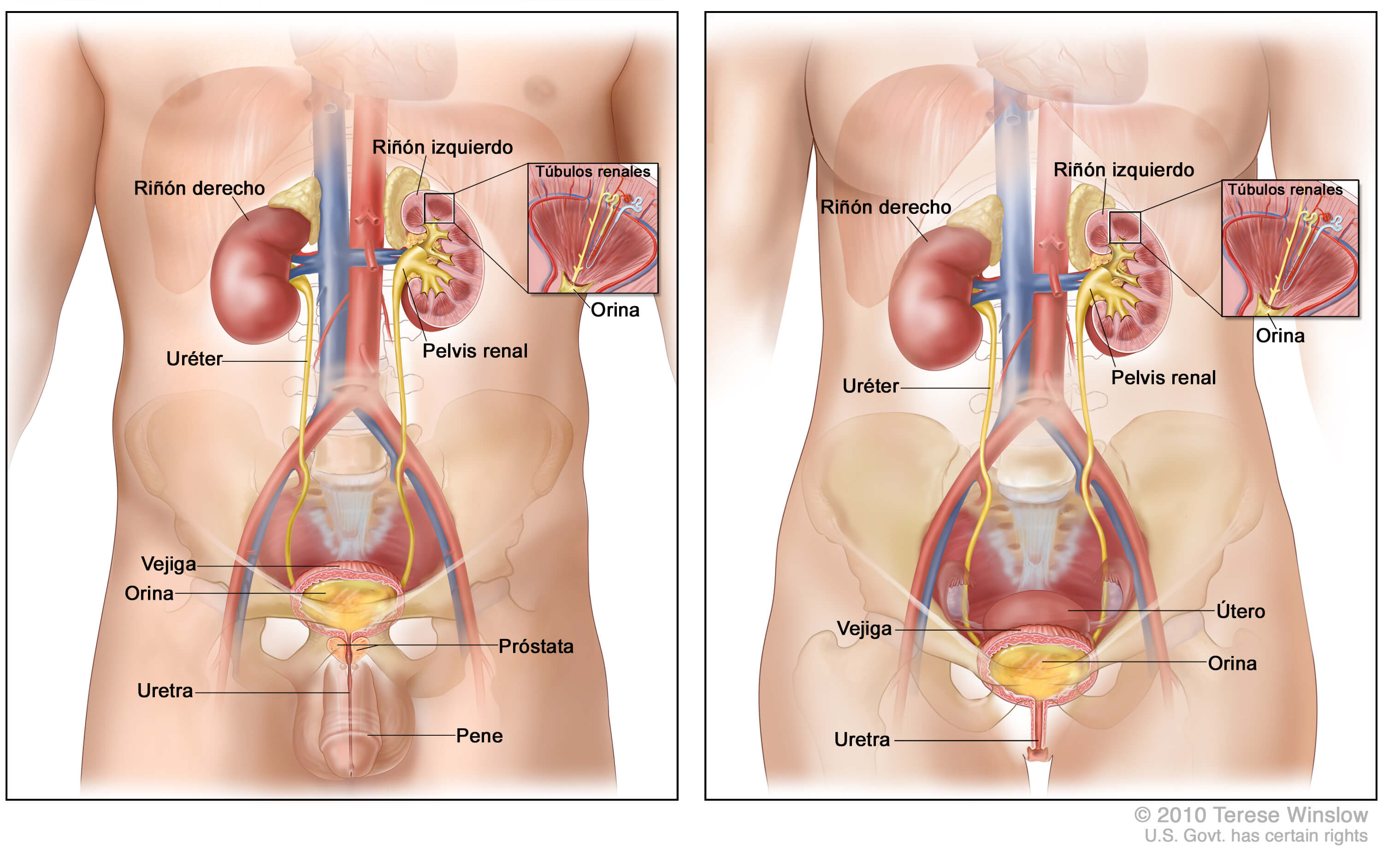
URL: https://www.cancer.gov/PublishedContent/Images/images/cancer-types/cthp/urinarysystem_male-female-spanish-enlarge.jpg - El riñón:
- Aparato urinario: pincha en la imagen para ver más grande la vejiga, los uréteres y los riñones
Etiquetas:
2016-2017,
Biología,
CEPA Santoña,
fyq2,
Naturales-2
jueves, 16 de abril de 2020
3 ejercicios del examen correspondiente al tema "Función lineal" (rectas, gráficas) con solución
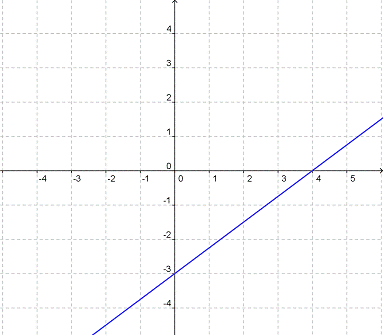
1. Representa la función y = -3x - 2
Respuesta:
2. Encuentra la función cuya gráfica es:
3. La entrada para entrar a una feria cuesta 6€. Puedes subir a cualquier atracción pagando 4 €/h .
Respuesta:
2. Encuentra la función cuya gráfica es:
Respuesta:
b = -3
a = y/x = 3/4
y = 3/4.x - 3
a) Halla la ecuación del precio a pagar en función del número de horas precio(€) = 4.tiempo (h) + 6
b) Realiza la gráfica que represente el precio que pagaremos en función del tiempo que lo utilicemos
Etiquetas:
- Función lineal,
2016-2017,
4º ESPA,
fyq2,
Matemáticas
Repaso examen ecuaciones de segundo grado (Matemáticas - ESPA 4)
Indica el número de soluciones:
Encuentra el valor de x (resolver):
Si multiplico un número por su triple obtengo 12. ¿Cuál es el número?
La superficie de un piso tiene forma rectangular. Si un lado es el doble de grande que el otro y la superficie total (el área) es de 50 metros cuadrados, halla las dimensiones del piso.
Alejandro tiene dos euros más que Alex. Si multiplicamos el dinero que tiene cada uno queda 15. Calcula cuanto tiene cada uno.
- 5x2 + 4x + 2 = 0
- 3x2 + 6x + 3 = 0
- 8x2 - x + 9 = 0
- 4x2 - 8x = 0
- 2x2 + 15 = 0
- 4x2 + 7x + 10 = 3x2 + 4x + 14
Encuentra el valor de x (resolver):
- 3x2 - 75 = 0
- 4x2 - 8x = 0
- 2x2 + 8x + 6 = 0
- 4x2 - 64 = 0
- x2 - 6x = 0
Si multiplico un número por su triple obtengo 12. ¿Cuál es el número?
La superficie de un piso tiene forma rectangular. Si un lado es el doble de grande que el otro y la superficie total (el área) es de 50 metros cuadrados, halla las dimensiones del piso.
Alejandro tiene dos euros más que Alex. Si multiplicamos el dinero que tiene cada uno queda 15. Calcula cuanto tiene cada uno.
Etiquetas:
2016-2017,
4º ESPA,
Ecuaciones,
Matemáticas
martes, 14 de abril de 2020
2º ESPA: Tema1, El aparato digestivo
Os dejo algunos enlaces interesantes sobre el tema.
- Apuntes del tema: https://drive.google.com/file/d/0BzcAlH1Q5jd3ajIyM0YzWEhVaDQ/view?usp=sharing
- Presentación multimedia: http://es.slideshare.net/fmedin1/aparato-digestivo-12025135
- Imagen del aparato digestivo: http://www.clarionweb.es/6_curso/c_medio/cm602/tema2/apardig.gif
- LIM sobre el aparato digestivo: http://personales.mundivia.es/igarrido/aparato_digestivo.html
- Aquí se encuentra la respuesta a la pregunta que hicistéis sobre la bilis: http://lasaludi.info/vomitos-de-bilis.html
- Alimentos "no tan saludables": http://elpais.com/elpais/2017/03/01/ciencia/1488369759_960687.html